OSTEOPOROSI
PATOLOGIA
Le osteoporosi secondarie sono invece quelle determinate da un ampio numero di patologie e farmaci.1
Comprende l’osteoporosi giovanile, postmenopausale e senile.2
Osteoporosi postmenopausale
La patogenesi è dovuta al deficit di estrogeni associato alla menopausa che determina un’accelerazione della perdita ossea dovuta all’invecchiamento.3
Presenta un profilo patologico scheletrico specifico.2

Osteoporosi giovanile
- mutazioni genetiche che possono comportare alterazioni quantitative o qualitative della componente connettivale dell’osso;
- un’alterata attività osteoblastica con interessamento soprattutto dell’osso trabecolare.
- immobilizzazione prolungata
- malattie infiammatorie croniche
- leucemia
- somministrazione cronica di farmaci come antiepilettici e glucocorticoidi.
- dell’anamnesi di una o più fratture vertebrali da fragilità;
- della presenza di una storia clinica (definita da almeno due fratture a carico delle ossa lunghe prima dei dieci anni o da tre o più fratture a carico delle ossa lunghe prima dei diciannove anni) in assenza di patologie locali, di traumi ad alta energia;
- leucemia;
- da uno Z-score della BMD ≤ -2,0 DS a livello del rachide lombare o della scansione Total Body Less Head (TBLH).
Osteoporosi secondaria
- Malattie endocrine (ipogonadismo, ipocortisolismo, acromegalia, diabete mellito)2
- Malattie ematologiche (talassemia, mieloma multiplo)2
- Malattie gastrointestinali (malassorbimento, celiachia)2
- Malattie reumatiche (artrite reumatoide, lupus eritematoso sistemico, spondilite anchilosante, sclerodermia)2
- Nefropatie (insufficienza renale, acidosi tubulare cronica)2
- Utilizzo di farmaci, come glucocorticoidi, anticoagulanti, diuretici2
Osteoporosi da glucocorticoidi


Osteoporosi da blocco ormonale nel carcinoma mammario e prostatico
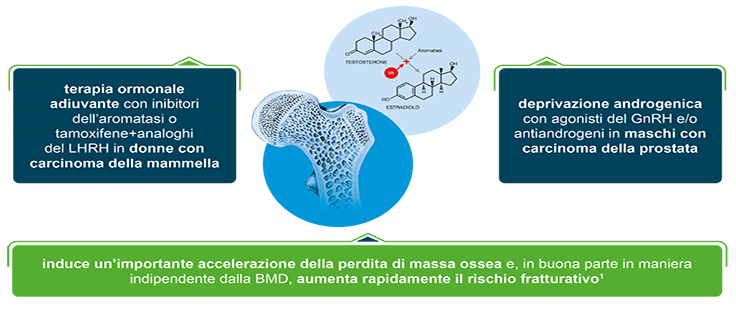
LA TERAPIA ORMONALE CON INIBITORI DELL’AROMATASI (IA)
- Gli inibitori dell’aromatasi (IA) bloccano la conversione degli androgeni in estrogeni, riducendo i livelli sierici circolanti di estrogeni4
- La terapia con IA determina una rapida e significativa perdita di massa ossea4
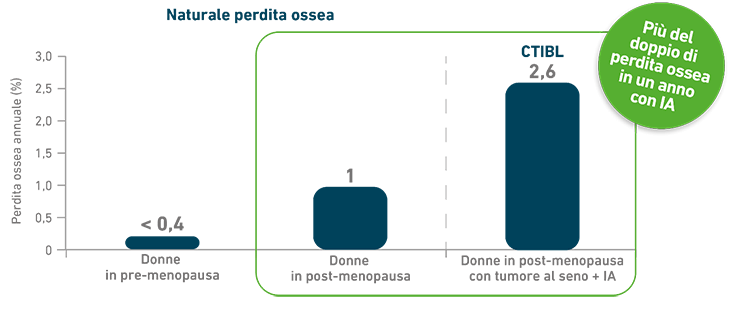
- La terapia con IA aumenta il rischio di fratture5
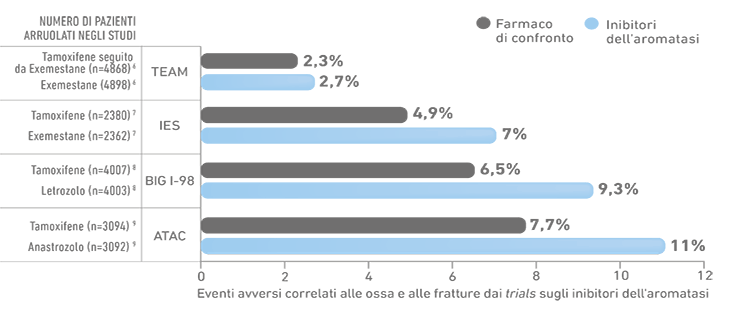
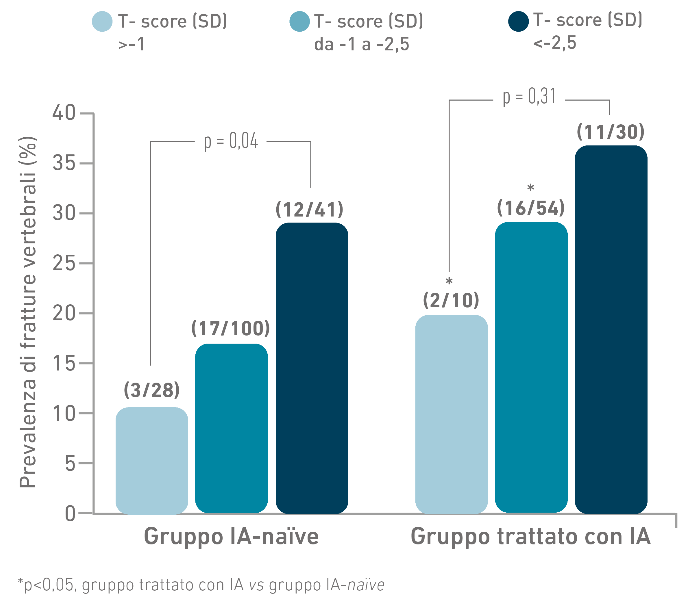
- Il rischio fratturativo da IA è sostanzialmente indipendente dalla BMD.1
La BMD nella CTIBL è spesso nella norma o modicamente ridotta anche in presenza di fratture vertebrali morfometriche 1
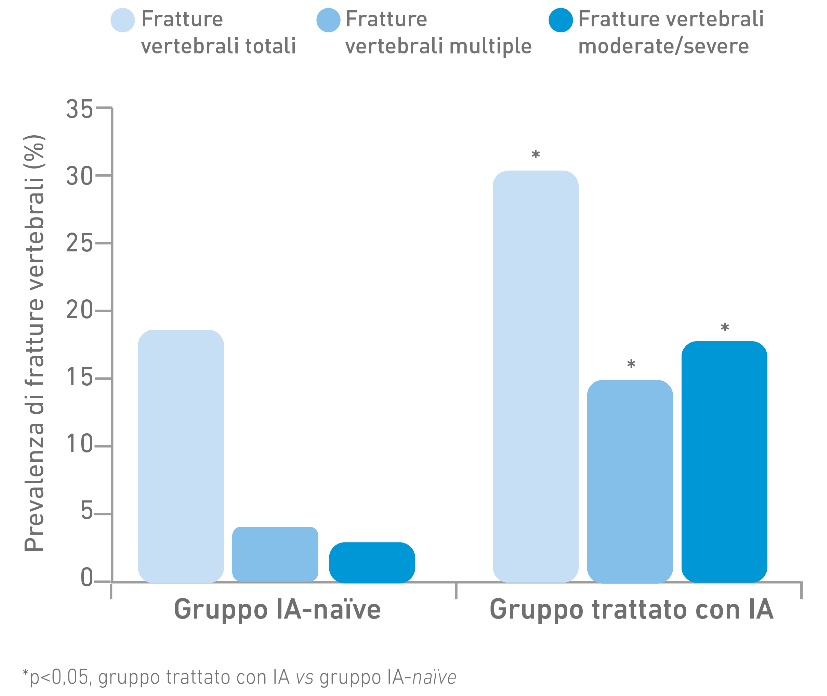
Maggiore prevalenza di fratture moderate/severe e fratture multiple vertebrali nelle pazienti in terapia con IA rispetto alle pazienti IA-naïve.3
LA DEPRIVAZIONE ANDROGENICA (ADT)

- La deprivazione androgenica provoca la riduzione dei livelli di testosterone circolanti che non vengono più convertiti in estrogeni12
- Modificando un assetto ormonale fondamentale per il controllo del rimodellamento osseo, la deprivazione androgenica accelera la perdita ossea e aumenta il rischio di frattura13
BIBLIOGRAFIA
- Linee Guida AIOM 2019 “Trattamento delle metastasi ossee”.
- I numeri del cancro in Italia 2019.
- Pedersini R et al. Bone 2017;97:147-152.
- Hadji P. Crit Rev Oncol Hematol 2009;69(1):73-82.
- Bauer M et al. Breast Cancer (Dove Med Press) 2012;4:91-101.
- van de Velde CJ et al. Lancet 2011;377(9762):321-331.
- Coombes RC et al. N Engl J Med 2004;350(11):1081-1092.
- The Breast International Group (BIG) 1-98 Collaborative Group. N Engl J Med. 2005;353(26):2747-2757.
- Cuzick J et al. Lancet Oncol 2010;11(12):1135-41.
- Linee Guida AIOM 2019 “Carcinoma della prostata”.
- Sartor O. Lancet Oncol 2019;20(2):176-177.
- Lipton A et al. Clinical Medicine Insights: Oncology 2012; 6: 287-303.
- Nota 79. G.U. della Repubblica Italiana del 30.03.17. Serie generale n.75.
Osteoporosi maschile
EPIDEMIOLOGIA



INCIDENZA DI OSTEOPOROSI E DI DIVERSE PATOLOGIE IN ITALIA.


BURDEN OF DISEASE
Fratture del femore

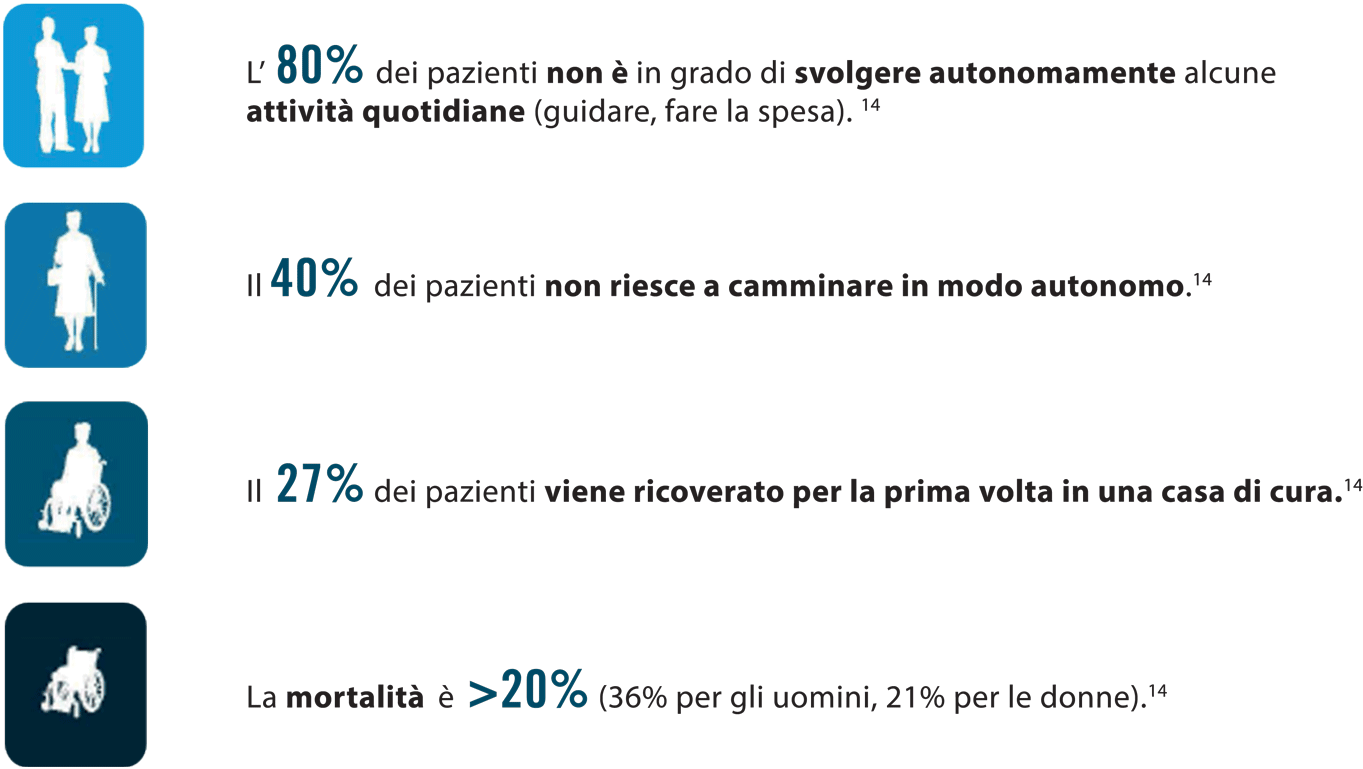
Solo il 40% dei pazienti con frattura femorale riacquista un grado di indipendenza pari a quello precedente l’evento.12
Fratture vertebrali

I costi dell’osteoporosi in Italia


IN CHE MISURA LE DIFFERENTI TIPOLOGIE DI FRATTURE IMPATTANO SUI COSTI?

FATTORI DI RISCHIO
Fattori di rischio
- Familiarità per frattura di femore
- Età avanzata
- Ipertiroidismo (incluso quello iatrogeno) o iperparatiroidismo
- Celiachia e altre sindromi da malassorbimento
- BMI < 20 kg/m2 o perdita di peso
- Anamnesi farmacologica, in particolare uso cronico di glucocorticoidi e farmaci che riducono l’assorbimento di calcio, vitamina D (antiepilettici)
- Artrite reumatoide
- Malattia epatica cronica
- Ridotta BMD del collo femorale
- Broncopneumopatia cronica ostruttiva (BPCO)
- Trapianto d’organo
- Diabete mellito di tipo 1
- Carenza di estrogeni (primaria o secondaria)
- Menopausa precoce (< 45 anni), inclusa quella chirurgica
- Immobilità prolungata e mancanza di esercizio fisico
- Abitudine al fumo
- Consumo di alcol giornaliero >3 unità
- Assunzione inadeguata di calcio e vitamina D (carenza nutrizionale)
- Mancanza di esposizione alla luce solare (può causare carenza di vitamina D)
I modelli FRAX sono stati sviluppati partendo dallo studio di coorti di popolazioni di Europa, Nord America, Asia e Australia.16
I fattori clinici dell’algoritmo frax

DIAGNOSI
- Z-score: indica la differenza rispetto a una popolazione sana di riferimento composta da soggetti dello stesso sesso, della stessa età e della stessa etnia (razza) della persona esaminata;
- T-score: indica la differenza rispetto a un’altra popolazione di riferimento composta da giovani adulti sani dello stesso sesso).


- donne di età ≥65 anni o uomini ≥70 anni, a prescindere dai fattori di rischio
- donne più giovani in post-menopausa, donne all’inizio della menopausa e uomini di età compresa tra 50 e 69 anni con fattori di rischio per fratture
- adulti con fratture in età ≥ 50 anni
- adulti con patologie o che assumono farmaci che possono provocare perdita di massa ossea
RUOLO DELLA PREVENZIONE
- assumere adeguate quantità di calcio e vitamina D
- praticare regolarmente esercizio fisico
- cessare l’utilizzo di tabacco
- evitare un eccessivo consumo di alcool
- eliminare i fattori di rischio di caduta

QUALI PAZIENTI TRATTARE CON FARMACI
Dovrebbero essere presi in considerazione per un trattamento tutte le donne in post-menopausa e gli uomini di età superiore a 50 anni con una delle seguenti caratteristiche:12
- una frattura femorale o vertebrale (clinicamente evidente o visibile all’imaging vertebrale);
- un valore al T-score ≤-2,5 al collo del femore, femore totale o colonna lombare;
- bassi valori di massa ossea (T-score compreso tra -1,0 e -2,5 al collo del femore o alla colonna lombare) e una probabilità a 10 anni ≥3% di incorrere in una frattura del femore oppure una probabilità a 10 anni ≥20% di avere una frattura correlata all’osteoporosi, sulla base dell’algoritmo della WHO.
REFERENZE
- Rossini M, et al. Linee guida per la diagnosi, la prevenzione ed il trattamento dell’osteoporosi. Reumatismo. 2016; 68(1):1-42.
- Tarantino U, et al. Clinical guidelines for the prevention and treatment of osteoporosis: summary statements and recommendations from the Italian Society for Orthopaedics and Traumatology. J Orthop Traumatol. 2017;18(Suppl 1):3-36.
- Commissione Intersocietaria per l’Osteoporosi. Linee Guida sulla gestione dell’Osteoporosi e delle Fratture da fragilità. Disponibile al sito: http://www.societaitalianadiendocrinologia.it/public/pdf/lg_osteoporosi.pdf. Ultimo accesso: 16 gennaio 2018.
- Linee guida AIOM (Associazione Italiana di Oncologia Medica). Trattamento delle metastasi ossee. Aggiornamento 27 ottobre 2017.
- European Union Osteoporosis Consultation Panel. Osteoporosis in the European Community: Action Plan. Health & Consumer Protection Directorate General; November 2003. Disponibile al sito: https://ec.europa.eu/health/archive/ph_projects/2002/promotion/fp_promotion_2002_a1_04_en.pdf. Ultimo accesso: febbraio 2018.
- Cavalli L, et al. Prevalence of osteoporosis in the Italian population and main risk factors: results of BoneTour Campaign. BMC Musculoskelet Disord. 2016;17(1):396.
- World Health Organization. WHO Scientific Group on the Prevention and Management of Osteoporosis. Prevention and management of osteoporosis. World Health Organ Tech Rep Ser 2003; 921:1-206.
- Svedbom A, et al. Epidemiology and Economic Burden of Osteoporosis in Italy. A report prepared in collaboration with the International Osteoporosis Foundation (IOF) and the European Federation of Pharmaceutical Industry Associations (EFPIA)Arch Osteoporos. 2013; 8: 137.
- European cardiovascular statistics 2017 edition
- http://www.registri-tumori.it Airtum 2017
- van Geel TA, et al. Clinical subsequent fractures cluster in time after first fractures. Ann Rheum Dis. 2009;68(1):99-102.
- Cosman F, et al. Clinician’s Guide to Prevention and Treatment of Osteoporosis. Osteoporos Int. 2014;25(10):2359-81.
- Ström O, et al. Osteoporosis: burden, health care provision and opportunities in the EU: a report prepared in collaboration with the International Osteoporosis Foundation (IOF) and the European Federation of Pharmaceutical Industry Associations (EFPIA). Arch Osteoporos. 2011;6:59-155.
- Cooper C. The crippling consequences of fractures and their impact on quality of life. Am J Med 1997;103(2A):12S-17S.
- Cauley JA, et al. Risk of mortality following clinical fractures. Osteoporos Int. 2000;11(7):556-61.
- Tella SH, Gallagher JC. Prevention and treatment of postmenopausal osteoporosis. J Steroid Biochem Mol Biol. 2014 Jul;142:155-70. doi: 10.1016/j. jsbmb.2013.09.008. Epub 2013 Oct 29.
- Ferrari S, et al. Unmet needs and current and future approaches for osteoporotic patients at high risk of hip fracture. Arch Osteoporos. 2016 Dec;11(1):37.
- SIOMMMS. Linee Guida per la Diagnosi, Prevenzione e Terapia dell’Osteoporosi. 2015.