Area Immunologia
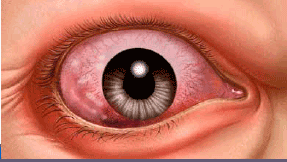
MALATTIA OCULARE TIROIDEA (TED)
Fisiopatologia
Guarda il meccanismo fisiopatologico della TED
- Propotosi6
- Strabismo6
- Ulcere corneali6
- Compressione del nervo ottico1
- Compromissione della vista6
- Diplopia6
- Neuropatia ottica che può portare anche a perdita permanente della vista6
REFERENZE
- Wang, Y., Patel, A., & Douglas, R. S. (2019). Therapeutics and Clinical Risk Management, 15, 1305-1318.
- Bahan, R.S. (2010). The New England Journal of Medicine, 362(8), 726-738.
- Patel, A., Yang, H., & Douglas, R. S. (2019). American Journal of Ophthalmology 2019, 208, 281- 288.
- Dik, W. A., Virakul, S., & van Steensel, L. (2016). Experimental Eye Research, 142, 83-91.
- Krieger, C. C., Boutin, A., Jang, D., et al. (2019). Endocrinology, 160(6), 1468-1479.
- Bruscolini, A., Sacchetti, M., La Cava, M., et al. (2018). Autoimmunity Reviews, 17(7), 639-643.
- Krieger, C.C., Place, R.F., Bevilacqua, C., et al. (2016). The Journal of Clinical Endocrinology and Metabolism, 101(6), 2340-2347.
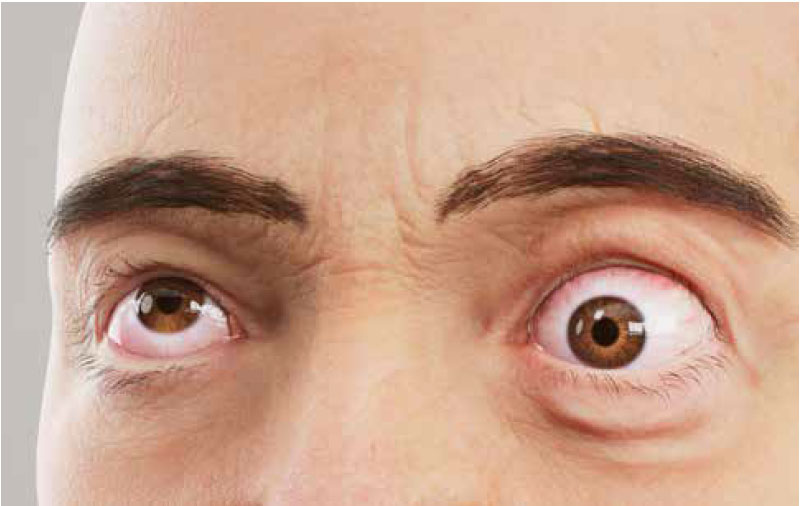
Segni e sintomi
Segni, sintomi e cause correlate6
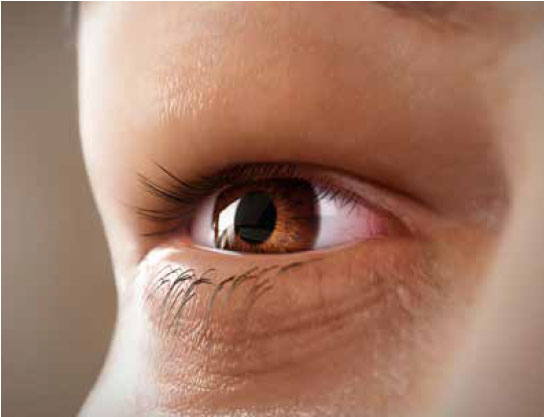
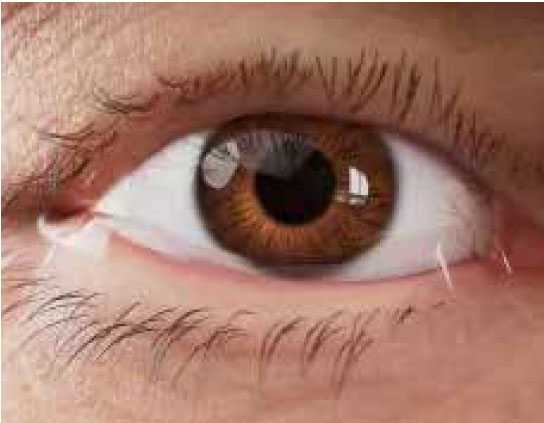
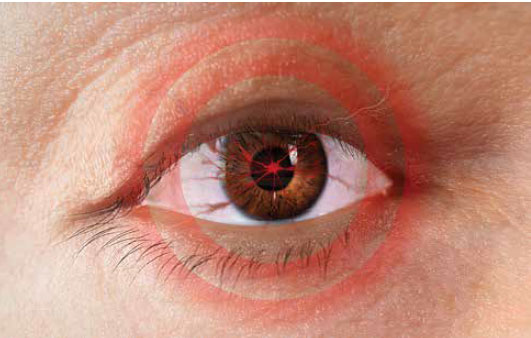
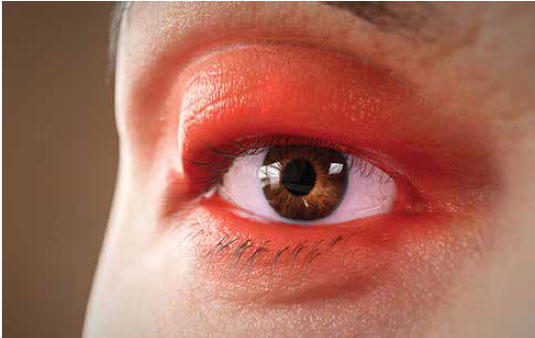
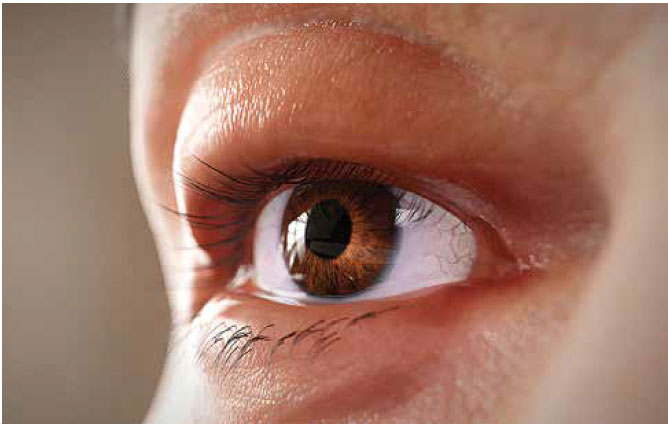
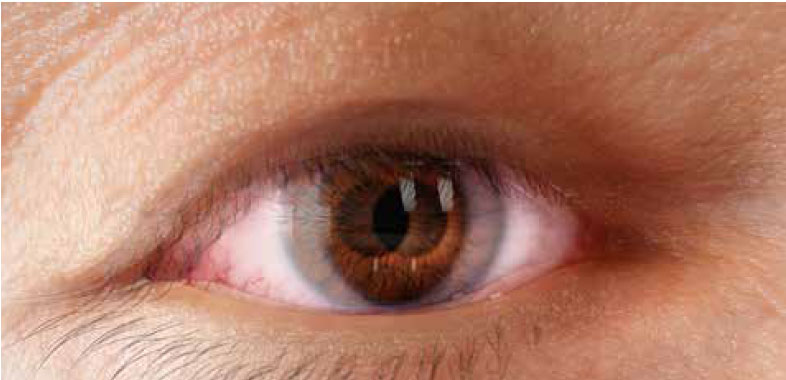
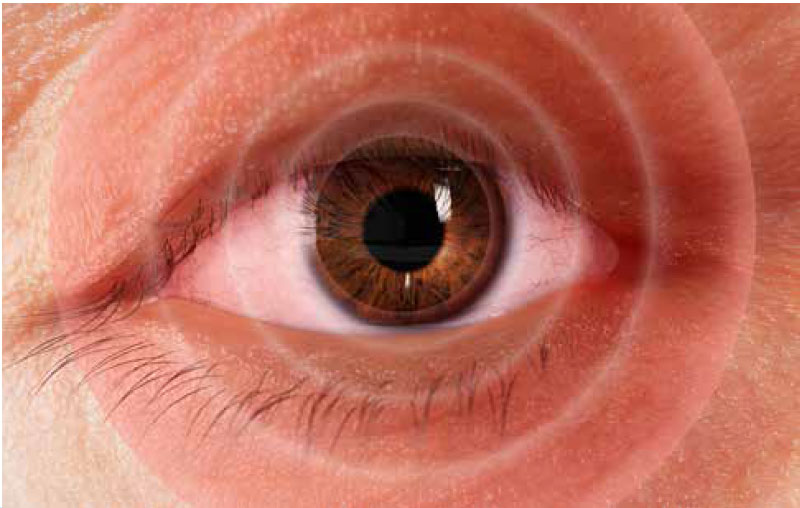
il movimento oculare
Burden of disease
Attività più frequentemente limitate dalla TED7

Leggere
45%

Guidare
28%

Socializzare
23%

Lavorare
16%

Depressione‡9
Circa il
40%
Ansia‡9
22%

Pazienti che evitano situazioni pubbliche†7
19%
Riduzione temporanea della capacità lavorativa10
21%

Riduzione permanente della capacità lavorativa10
6%

Perdita del lavoro o pensionamento anticipato10
8%
Diagnosi e classificazioni
CLASSIFICAZIONE DELLA TED SECONDO SEVERITÀ
Documento di Consenso ATA-ETA sulla TED11

- Retrazione palpebrale lieve (<2 mm)
- Coinvolgimento lieve dei tessuti molli
- Proptosi <3 mm al di sopra dei valori normali per razza e sesso
- Diplopia transitoria o assente
- Esposizione corneale responsiva a lubrificanti

- Retrazione palpebrale (≥2 mm)
- Coinvolgimento moderato-severo dei tessuti molli
- Proptosi ≥3 mm al di sopra dei valori normali per razza e sesso
- Diplopia (punteggio di Gorman 2-3)

IGF-1R: recettore del fattore di crescita insulino-simile 1; TED: Thyroid Eye Disease; TSH: ormone tireostimolante; TSHR: recettore per l’ormone tireostimolante.
† Indagine condotta su 394 pazienti con TED che hanno risposto al questionario di 62 domande per valutare l’esperienza di vita con la TED nei 2 mesi precedenti l’indagine.7
*La disabilità occupazionale è stata valutata in uno studio condotto in Germania su 250 pazienti con TED.10
BIBLIOGRAFIA
- Wang y et al. Thyroid Eye Disease: How A Novel Therapy May Change The Treatment Paradigm. Therapeutics and Clinical Risk Management 2019;15:1305-1318.
- Patel A et al. A New Era in the Treatment of Thyroid Eye Disease. Ophthalmol 2019;208:281-288.
- Dik WA et al. Current perspectives on the role of orbital fibroblasts in the pathogenesis of Graves’ ophthalmopathy. Experimental Eye Research 2016;142:83-91.
- Krieger CC et al. Arrestin-b-1 Physically Scaffolds TSH and IGF1 Receptors to Enable Crosstalk. Endocrinology 2019;160:1468-1479.
- Bruscolini A et al. Quality of life and neuropsychiatric disorders in patients with Graves’ Orbitopathy: Current concepts. Autoimmunity Reviews 2018;17:639-643.
- Barrio-Barrio J et al. Graves’ Ophthalmopathy: VISA versus EUGOGO Classification,Assessment, and Management. Journal of Ophthalmology 2015; 2015:2015:249125.
- Smith TJ et al. How patients experience thyroid eye disease. Front. Endocrinol. 2023; 14:1283374.
- Ponto KA et al. Quality of Life and Occupational Disability in Endocrine Orbitopathy. Dtsch Arztebl Int 2009; 106(17):283-9.
- Sharma A et al. Measuring Health-Related Quality of Life in Thyroid Eye Disease. The Journal of Clinical Endocrinology & Metabolism 2022; 107:S27-S35.
- Wiersinga WM et al. Quality of life in Graves’ ophthalmopathy. Best Practice & Research Clinical Endocrinology & Metabolism 2012; 26: 359-370.
- Burch HB et al. Management of Thyroid Eye Disease: A Consensus Statement by the American Thyroid Association and the European Thyroid Association. THYROID 2022; 32 (12).
- Bartley GB. The epidemiologic characteristics and clinical course of ophthalmopathy associated with autoimmune thyroid disease in olmsted county, Minnesota. Trans Am Ophthalmol Soc.1994; 92:477-588.



