Leucemia Linfoblastica Acuta
L’incidenza della LLA in età pediatrica in Italia è di circa 3,5 casi all’anno per 100.000 persone, ed il numero stimato di nuovi casi/anno è di circa 400 mentre l’incidenza nella popolazione adulta è di circa 0,7 casi all’anno per 100.000 persone, con una stima di circa 450 nuovi casi all’anno in Italia.5
Sebbene le strategie di intensificazione della dose abbiano portato a un miglioramento significativo dei risultati per i pazienti pediatrici, la prognosi per i soggetti di età più avanzata rimane molto scarsa. Infatti, nonostante un alto tasso di risposta alla chemioterapia di induzione, solo il 30-40% dei pazienti adulti con LLA è in grado di ottenere una remissione a lungo termine.2
Altri fattori predisponenti comprendono l'esposizione a radiazioni ionizzanti, pesticidi, alcuni solventi o virus come l’Epstein-Barr o l’HIV.2
La presentazione della LLA può essere aspecifica, con una combinazione di sintomi costituzionali e segni di insufficienza midollare (anemia, trombocitopenia, leucopenia). I sintomi più comuni includono i cosiddetti ‘sintomi B’ (febbre, perdita di peso, sudorazione notturna), facilità all’emorragia o alla comparsa di lividi, affaticamento, dispnea e infezioni.2
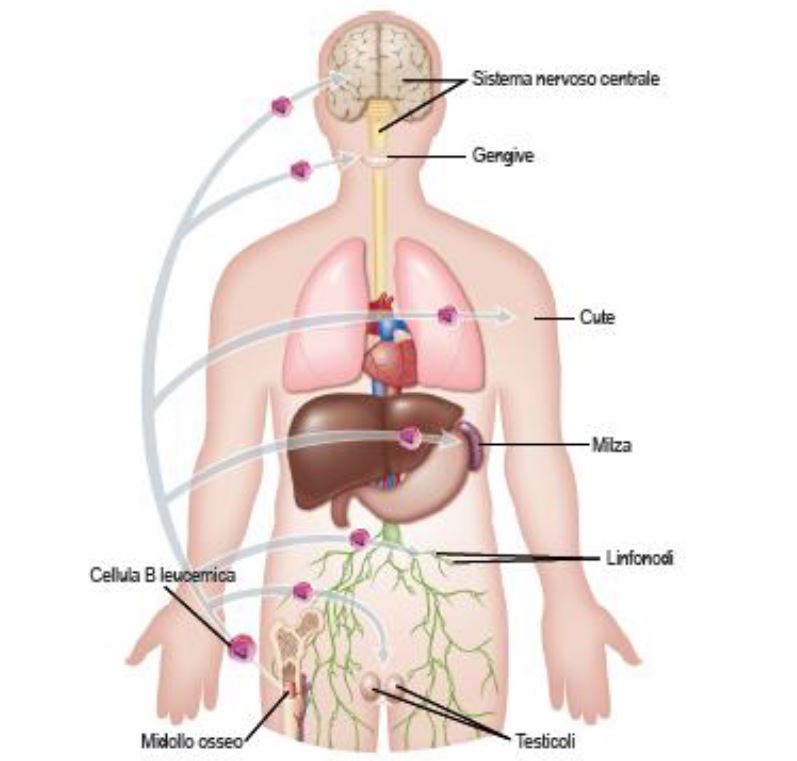
Il coinvolgimento di siti extramidollari si verifica comunemente e può causare linfoadenopatia, splenomegalia o epatomegalia nel 20% dei pazienti.
La stratificazione del rischio consente al medico di determinare il regime di trattamento più appropriato e quando considerare il trapianto allogenico di cellule staminali (Allo-SCT). Storicamente, i criteri utilizzati per la stratificazione del rischio sono stati l'età e la conta leucocitaria al momento della diagnosi. L'aumento dell'età è un fattore predittivo di prognosi peggiore. I pazienti di età superiore ai 60 anni hanno prognosi molto scarse, con una sopravvivenza a lungo termine del 10-15%.2
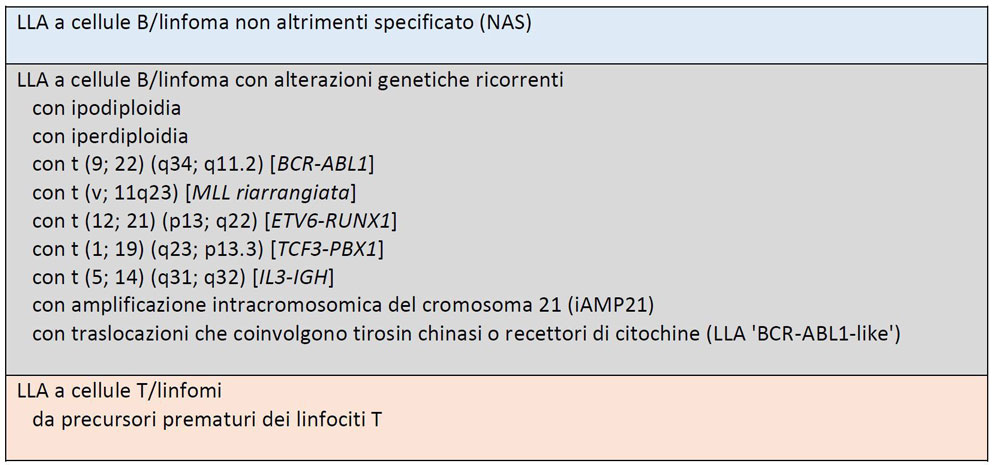
Sebbene i fattori clinici svolgano un ruolo importante nella scelta della terapia, le variazioni citogenetiche hanno un ruolo significativo nella determinazione del rischio. L'aberrazione citogenetica con il maggiore impatto sulla prognosi e sul trattamento è la presenza del cromosoma Philadelphia, t (9; 22) che negli adulti rappresenta la mutazione genetica più frequente con una prevalenza dal 10 al 50% che aumenta con l'età.2
Storicamente, la sopravvivenza a 1 anno nei soggetti affetti da LLA Ph-positivi è di circa il 10%.
Inoltre la persistenza di malattia minima residua (MRD) dopo i cicli di induzione o consolidamento rappresenta un altro importante fattore predittivo di prognosi negativa a causa dell’aumentato rischio di recidiva nei pazienti MRD positivi.6
Le opzioni di terapia di salvataggio per i pazienti R/R Ph-negativa comprendono l’aumento della chemioterapia citotossica e la riformulazione della chemioterapia con un singolo agente.2 Tuttavia, nonostante questo approccio sia in grado di ottenere un modesto effetto di prolungamento della sopravvivenza, la tossicità della terapia citotossica multi-agente può essere limitante e l'unica speranza per la sopravvivenza a lungo termine rimane l’Allo-SCT.2
Tuttavia, recentemente, i nuovi trattamenti immunoterapici hanno modificato lo scenario della terapia di salvataggio offrendo una possibilità di cura che potenzialmente possa anche evitare l’effettuazione di Allo-SCT.2
BIBLIOGRAFIA
- Leukemia & Lymphoma Society. Acute lymphoblastic leukemia. Revised 2016. http://www.lls.org/resourcecenter/freeeducationmaterials/leukemia/all. Accesso in data 15 Ottobre 2018.
- Terwillinger T, Abdul-Hay M. Acute lymphoblastic leukemia: a comprehensive review and 2017 update. Blood Cancer J 2017; 7 (6): e577.
- Associazione Italiana Ematologica Oncologia Pediatrica (AIEOP). Leucemia Linfoblastica Acuta. http://www.aieop.org/web/famiglie/schede-malattia/leucemia-linfoblastica-acuta/. Accesso in data 15 Ottobre 2018.
- National Comprehensive Cancer Network. NCCN Clinical Practice Guidelines in Oncology. Acute Lymphoblastic Leukemia. V1.2018 – March 12, 2018. http://www.nccn.org. Accesso in data 15 Ottobre 2018.
- Katz A, et al. Acute lymphoblastic leukemia: an assessment of international incidence, survival, and disease burden. Cancer Causes Control 2015;26:1627–42.
- Locatelli F, et al. How I treat relapsed childhood acute lymphoblastic leukemia. Blood. 2012;120(14):2807-2816.
- Brüggemann M, et al. Minimal residual disease in adult ALL: technical aspects and implications for correct clinical interpretation. Blood Adv. 2017 Nov 28;1(25):2456-2466.