Mieloma Multiplo
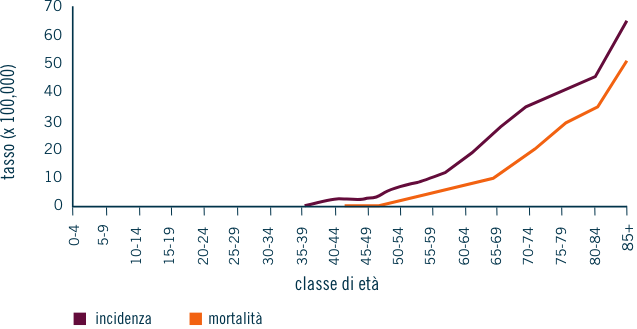

Eziologia
Sintomi della malattia
Inoltre i pazienti affetti da MM possono sviluppare anche amiloidosi che non colpisce soltanto i reni, ma anche cuore ed altri organi.4
Si definisce anemia una concentrazione di emoglobina <10 g/dL.4 Alla diagnosi, l’anemia normocromica normocitica è presente in due terzi dei pazienti affetti da mieloma multiplo, ma col tempo è riscontrabile in quasi tutti i pazienti.5
Diagnosi
- plasmacellule clonali midollari ≥60%
- rapporto tra catena leggera coinvolta/non coinvolta ≥100; la catena leggera monoclonale deve essere ≥100 mg/L
- >1 lesione focale, visualizzata con Risonanza Magnetica (MRI)
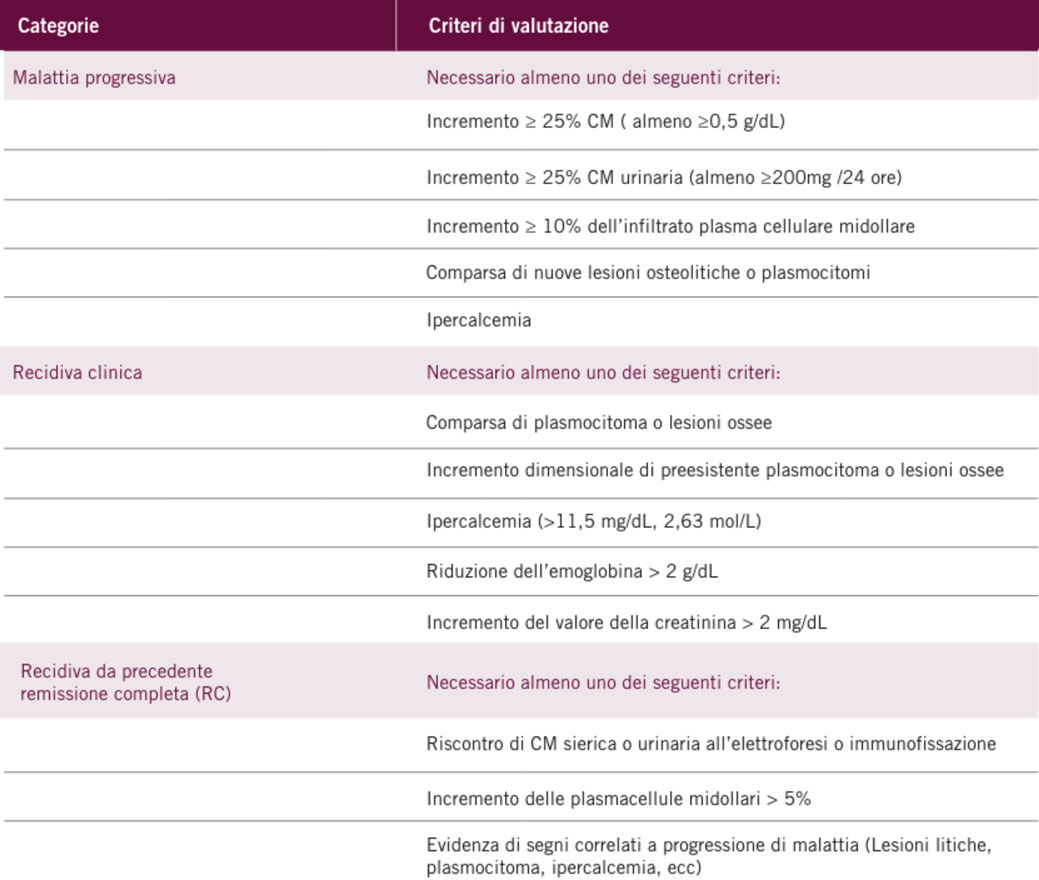
Mieloma multiplo recidivato o refrattario
Per MM recidivato si intende un MM precedentemente trattato che richiede una nuova terapia di salvataggio dopo un intervallo di remissione parziale o completa di almeno 60 giorni. La definizione di recidiva di malattia segue i criteri dell’International Myeloma Working Group riportati nella tabella sottostante:1
Ruolo del proteasoma nella cellula mielomatosa
Il complesso proteico del proteasoma svolge il ruolo di rimozione delle proteine danneggiate dalla plasmacellula, coadiuvato da enzimi aventi la funzione di lisi delle catene di amminoacidi.6 Considerata la necessità di smaltire l’accumulo di grosse quantità di proteine, il proteasoma (noto anche come 26S) riesce a soddisfare a stento il bisogno della cellula neoplastica, suggerendo così una debolezza della plasmacellula da poter sfruttare nella terapia contro il mieloma multiplo.6
BIBLIOGRAFIA
- Linee guida AIOM Mieloma 2017
- Swerdlow SH et al., WHO Classification of Tumours of Haematopoietic and Lymphoid Tissues, Revised 4th Edition , International Agency for Research on Cancer Lyon, 2017
- Rajkumar et al. Lancet Oncol 2014; 15: e538-48.
- Kumar K. et al. Nature 2017; 17046.
- Group. British Journal of Haematology, 2003,121, 749-757.
- Appel A nature 2011;480:S40-42